Потанин Сергей Сергеевич
«Роль терапевтического лекарственного мониторинга антипсихотиков
в индивидуализации терапии обострения
приступообразно-прогредиентной шизофрении»
Медицинские науки
Д 001.028.01
Федеральное государственное бюджетное научное учреждение
«Научный центр психического здоровья»
115522 Москва, Каширское шоссе, 34
Телефон диссовета: (499) 617-70-65
e-mail: dissovet@psychiatry.ru
Дата защиты диссертации – 7 декабря 2015 г.
Дата размещения диссертации
на официальном сайте ФГБНУ НЦПЗ – 3 сентября 2015 г.
На правах рукописи
Потанин Сергей Сергеевич
РОЛЬ ТЕРАПЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО МОНИТОРИНГА АНТИПСИХОТИКОВ В ИНДИВИДУАЛИЗАЦИИ ТЕРАПИИ ОБОСТРЕНИЯ ПРИСТУПООБРАЗНО-ПРОГРЕДИЕНТНОЙ ШИЗОФРЕНИИ
Специальность: 14.01.06 –Психиатрия (медицинские науки)
А в т о р е ф е р а т
диссертации на соискание ученой степени кандидата
медицинских наук
Москва – 2015
Работа выполнена в Федеральном государственном бюджетном научном учреждении «Научный центр психического здоровья»
Научный руководитель:
доктор медицинских наук Морозова Маргарита Алексеевна
Научный консультант:
доктор медицинских наук Мирошниченко Игорь Иванович
Официальные оппоненты:
Данилов Дмитрий Сергеевич, доктор медицинских наук, Клиника психиатрии им. С.С. Корсакова Первого московского государственного медицинского университета им. И.М. Сеченова, заведующий третьим общепсихиатрическим отделением
Цукарзи Эдуард Эдуардович, кандидат медицинских наук, Федеральное государственное бюджетное учреждение «Федеральный медицинский исследовательский центр психиатрии и наркологии им В.П. Сербского» Министерства здравоохранения Российской Федерации, руководитель отделения нелекарственных методов лечения с блоком интенсивной терапии
Ведущая организация:
Федеральное государственное бюджетное учреждение «Санкт-петербургский научно-исследовательский психоневрологический институт им. В.М. Бехтерева»
Защита состоится « » декабря 2015 г. в 11:00 на заседании диссертационного совета Д 001.028.01 в Федеральном государственном бюджетном научном учреждении «Научный центр психического здоровья» по адресу: 115522, Москва, Каширское шоссе, дом 34
С диссертацией можно ознакомиться в библиотеке и на сайте Федерального государственного бюджетного научного учреждения «Научный центр психического здоровья» http://www.ncpz.ru
Автореферат разослан _____ октября 2015
Ученый секретарь
диссертационного совета
кандидат медицинских наук Никифорова Ирина Юрьевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования. Проблема недостаточно эффективного лекарственного ответа при терапии обострения шизофрении является одной из ведущих для современной психиатрии. По различным данным, до 40 % пациентов, несмотря на проводимое лечение, не достигают достаточного качества ремиссии [Conley R.R., Buchanan R.W., 1997; Kahn R.S. et al., 2008; Lieberman J.A. et al., 2005; Jauhar S. et al., 2012]. С этой проблемой в значительной степени перекликается вопрос сложности эмпирического подбора терапии. Нередко на то, чтобы найти подходящий именно данному пациенту препарат и его дозировку, уходит несколько месяцев стационарного лечения. Такая ситуация приводит как к значительному экономическому ущербу [Любов Е. Б. и соавт., 2012], так и к негативным последствиям для пациентов, связанных с нанесением вреда здоровью во время неэффективных курсов терапии, возможным развитием госпитализма, негативным психологическим эффектам, связанным с длительным пребыванием в условиях острого отделения психиатрического стационара [Путятин Г.Г., 2008]. В настоящее время психиатрам приходиться подбирать психофармакотерапию эмпирическим путём [Дмитриева Т.Б., 2009; Мосолов С. Н., 2004.; Buchanan R.W. et al., 2010; Correll C.U., 2011; Edlinger M. et al., 2009; Hamann J. et al., 2004; Mendel R. et al., 2010; Weinmann S. et al., 2008], так как лабораторных или инструментальных методов, помогающих в выборе схемы терапии, в рутинной практике не используется. При этом, зачастую врачи-практики сталкиваются с ситуацией, когда назначение рекомендованных доз одного и того же антипсихотического препарата у схожих по клинической картине заболевания пациентов может приводить к различным результатам лечения. Важно отметить, что лекарственный ответ является сложной конструкцией, включающей в себя элементы, связанные как с биологическими (трансформация препарата в организме, преодоление препаратом гематоэнцефалического барьера, состояние рецепторной и медиаторных систем мозга больного), так и с психологическими аспектами (надёжность комплаентности, отношение к терапии, отношение к заболеванию, качество терапевтического альянса, индивидуальная социальная ситуация). Окончательных ответов на вопросы, почему в какой-то момент времени у определённых пациентов со сходной симптоматикой и историей заболевания один и тот же препарат может приводить или не приводить к достаточной редукции психотических симптомов, на данный момент нет. Можно допустить, что в значительной степени недостаточный эффект терапии связан с особенностями фармакодинамики (состоянием рецепторов у конкретного пациента, их изменениями под действием предыдущей лекарственной терапии и др.) [Conley R.R., Buchanan R.W., 1997; Nnadi C.U., Malhotra A.K., 2007]. Тем не менее, анализ данных литературы свидетельствует в пользу того, что и особенности фармакокинетики могут оказывать значительное влияние на клинический эффект антипсихотиков (АП) [Потанин С.С., 2013; Hiemke C. et al., 2011; Mauri M.C. et al., 2007]. Существует несколько предпосылок, позволяющих предположить клиническую значимость взаимоотношения эффективности терапии обострения шизофрении и концентрации антипсихотиков в плазме крови. Во-первых, сведения о том, что степень блокады допаминовых рецепторов второго типа, влияющая на эффективность терапии АП при обострении шизофрении [Kapur S. et al.,2000; Lodge D.J., Grace A.A., 2007; Yilmaz Z. et al., 2012], коррелирует с концентрацией АП в плазме крови в большей степени, чем с дозой (Hiemke C. et al. [143]). Имеются также и клинические исследования, подтверждающие влияние концентрации АП на клинический ответ [Dahl S.G., 1982; Hasegawa M. et al., 1993; Midha K.K. et al., 1993; Müller M.J. et al., 2007; Olesen O.V., 1998; Olesen O.V., Linnet K., 1999], хотя окончательной ясности в этом вопросе ещё нет, так как часть работ показала отрицательный результат [DeVane C.L., Nemeroff C.B., 2001; Fellows L. et al., 2003; Lostia A.M. et al., 2009; Panagiotidis G. et al., 2007; Seto K. et al., 2011]. Во-вторых, существуют данные о широкой вариабельности концентраций АП в плазме крови при сравнимых дозах у различных пациентов [Bachmann C.J.et al., 2008; Dahl S.G., Hals P.A., 1987; Molden E. et al., 1982; Preskorn S.H. et al., 1993; Preskorn S. H ., 2008]. В дополнение к этим соображениям можно также отметить проблему комплаентности пациентов с обострением шизофрении [Данилов Д.С., 2011; Мосолов С. Н., 2012; Незнанов Н.Г, Вид В.Д., 2004; Stephenson J.J. et al., 2012; Thieda P. et al., 2003]. При отсутствии объективных данных о концентрации АП в плазме крови в сочетании с недостаточной эффективностью терапии, сложно быть уверенным в том, что пациент на самом деле получает адекватное лечение. Не менее важной проблемой терапии обострения шизофрении являются побочные эффекты (ПЭ) проводимого лечения [Arana G.W., 2000; Shirzadi A.A., 2006; Ghaemi S.N., 2009]. В отношении многих из них доказана связь с концентрацией АП – так называемые дозозависимые ПЭ. К ним относятся в том числе экстрапирамидная симптоматика (ЭПС) [Van Putten T. et al., 1991], гиперпролактинемия [Volavka J. et al., 2004] и избыточная седация [Arana G.W., 2000]. При этом, учитывая широкую вариабельность концентрации АП, у части пациентов появление выраженных дозозависимых ПЭ может быть связано с повышенной относительно оптимального терапевтического диапазона концентрацией препаратов в плазме крови.
Одним из возможных способов оптимизации терапии в этой ситуации может стать терапевтический лекарственный мониторинг (ТЛМ), который используется для индивидуального подбора дозы в различных областях медицины, например, в эпилептологии [Соколов А.В., 2002], где в том числе измеряется концентрация препаратов, используемых и при лечении психических заболеваний (вальпроевая кислота, ламотриджин и др.). В психиатрии ТЛМ является рутинным методом оптимизации дозы карбоната лития [Нуллер Ю. Л., Михаленко И. Н., 1988; Licht R.W., 2012]. В некоторых странах ТЛМ используется и в отношении других психотропных препаратов, в том числе АП [Baumann P. et al., 2004; Hiemke C.et al., 2011]. Таким образом, вопрос взаимосвязи концентрации АП в плазме крови и лекарственного ответа в плане эффективности и выраженности ПЭ при терапии обострения шизофрении представляется актуальным в связи с перспективой применения ТЛМ АП для индивидуализации лечения этого состояния.
Степень разработанности темы исследования. Исследования связи лекарственного ответа с концентрацией АП в отечественной литературе практически не представлены. Существует значительное количество работ относительно методик определения концентраций АП вне связи с оценкой клинического ответа [Булатов Р.М., 2012; Калёкин Р. А., 2012; Купчиков В. В., 2003; Лазарян Д.С., 2013; Лукьянчиков П. Ю., 2004; Мелентьев А.Б. и Лаврентьева А. В., 2010; Писарев В.В., 2013; Раменская Г.В., 2006; Ремезова И.П., 2010,2014; Скорнякова А. Б., 2008]. Кроме того, в исследованиях Курылева А.А., 2012 и Филимоновой А.А., 2009, была прослежена связь между активностью системы цитохромов P450 и выраженностью ПЭ проводимой терапии, но непосредственного измерения концентраций АП в данных работах не проводилось. В зарубежной литературе подобные исследования представлены относительно широко [Baumann P. et al., 2004; Dahl S.G., 1982; Hasegawa M., 1993; Midha K.K. et al., 1993; Müller M.J. et al., 2007; Olesen O.V. et al., 1998; Olesen O.V., Linnet K., 1999], разработаны клинические рекомендации по применению ТЛМ АП в психиатрической практике с дифференцированным подходом [Hiemke C. et al., 2011]. В то же время стоит отметить, что данные рекомендации в большинстве своём основаны на данных клинических исследований, в которых производился искусственный отбор пациентов, ограничивалась сопутствующая терапия и изучался один конкретный препарат. Работ, касающихся рутинной практики, немного и трансполяция их результатов на российскую действительность невозможна в связи со значительным отличиями в паттернах назначения АП [Потанин С.С. и соавт., 2014].
Цель исследования: Определить клиническую значимость влияния концентрации АП на качество раннего терапевтического ответа у пациентов с обострением приступообразно-прогредиентной шизофрении.
Задачи исследования:
1. Изучить основные паттерны назначения антипсихотиков при лечении обострения шизофрении в рутинной клинической практике для формирования модели исследования.
2. Выявить клинико-психопатологические факторы, наиболее значимые в отношении прогноза раннего терапевтического ответа при обострении шизофрении, с целью их учета при анализе влияния концентрации антипсихотиков.
3. Оценить степень вариабельности концентрации антипсихотиков в плазме крови больных при применении препаратов в рекомендованных инструкцией дозах.
4. Исследовать влияние индивидуальных особенностей концентрации антипсихотиков в плазме крови на эффективность раннего терапевтического ответа при обострении шизофрении.
5. Определить клиническую значимость отклонения концентрации антипсихотиков от оптимального терапевтического диапазона в отношении побочных эффектов терапии.
6. Оценить целесообразность использования терапевтического лекарственного мониторинга антипсихотиков для индивидуализации терапии обострения шизофрении в практике.
Научная новизна работы. Впервые исследовалась связь концентрации АП с лекарственным ответом на лечение обострения шизофрении в российской практике. До этого было проведено несколько работ, касающихся методики определения концентрации антипсихотиков [Лукьянчиков П.Ю., 2004; Мелентьев А.Б. и Лаврентьева А. В., 2010; Ремезова И.П., 2010, 2014], в том числе в рамках токсикологии [Скорнякова А.Б., 2008; Лазарян Д.С., 2013], но вне связи с терапевтическим ответом. В определённой степени смежными с изучаемой темой являются работы посвященные влиянию особенностей функционирования системы цитохромов Р450 на клинический ответ [Филимонова А. А., 2009; Объедков В.Г., 2014; Иванов М. В., 2012], но измерения концентрации антипсихотиков в них не проводилось. В отличие от большинства зарубежных исследований на эту тему [Perry P.J. et al., 2001; Potkin S.G. et al., 1994; Müller M.J. et al., 2007; Bowskill S.V. et al., 2002–2010; Tugg L.A. et al., 1997], данная работа была посвящена оценке связи между концентрацией антипсихотиков и клиническим ответом в условиях рутинного лечения с минимальными ограничениями относительно сопутствующей терапии, что позволяет делать выводы, касающиеся применения терапевтического лекарственного мониторинга в условиях рутинной практики. Впервые в российской научной практике была исследована взаимосвязь ПЭ и концентраций АП в плазме крови, причём как клинически определяемых ПЭ, так и некоторых лабораторных показателей (уровней глюкозы, дегидроэпиандростерона (ДГЭА), пролактина в крови). Данное исследование, в отличие от большинства других, имело своей целью не просто изучение концентрации АП, но и оценку практической значимости их измерения для оптимизации терапии пациентов с обострением шизофрении, как важной проблеме психофармакологии. Важно отметить, что в рамках данной работы впервые были разработаны рекомендации по применению ТЛМ АП с учётом особенностей российской психиатрической практики.
Теоретическая значимость исследования определяется решением вопроса о связи между лекарственным ответом на терапию обострения шизофрении и концентрацией АП в плазме крови пациентов. Кроме того, результаты исследования отражают особенности динамики клинической картины в зависимости от концентрации АП в отношении позитивных, негативных и общих симптомов обострения шизофрении, что является значимым результатом с точки зрения психопатологии и психофармакологии.
Практическая значимость исследования состоит в решении задачи по оценке целесообразности применения терапевтического лекарственного мониторинга антипсихотиков для индивидуализации терапии обострения приступообразно-прогредиентной шизофрении. Результаты исследования показали, что одной из причин недостаточной эффективности и выраженных побочных эффектов лечения является отклонение концентрации антипсихотиков от оптимального терапевтического диапазона. При этом отмечен широкий разброс концентраций этих препаратов в плазме крови больных, несмотря на назначение рекомендованных по инструкции дозировок. Таким образом, применение терапевтического лекарственного мониторинга антипсихотиков для индивидуализации терапии обострения приступообразно-прогредиентной шизофрении может улучшить качество оказания медицинской помощи и оптимизировать материальные затраты при обострении шизофрении. Автором были созданы методические рекомендации по использованию этого метода.
Этические принципы. Исследование проводилось в соответствии с юридическими и этическими нормами, предусмотренными Хельсинкской Декларацией, действующим законодательством РФ, а также принципами Качественной Клинической Практики (GCP).
Объект исследования: пациенты, поступившие в стационар в связи с обострением шизофрении.
Предмет исследования: Взаимосвязь концентрации АП в плазме крови с лекарственным ответом при лечении обострения шизофрении в условиях стационара.
Общая гипотеза: Концентрация АП в плазме крови оказывает влияние на лекарственный ответ в отношении эффективности терапии и выраженности ПЭ.
Теоретико-методологическая основа. Теоретическими предпосылками для исследования стали данные о значительной вариабельности концентраций АП у различных пациентов в сочетании с наличием проблемы недостаточного лекарственного ответа на проводимую антипсихотическую терапию при обострении шизофрении. Методология была разработана с учётом опыта других отечественных и зарубежных исследований, изучавших взаимосвязи между клиническими эффектами лекарственных препаратов и их концентрацией в плазме крови.
Методы исследования:
1. Клинико-психопатологический.
2. Психометрический.
3. Масс-спектрометрический для ТЛМ.
4. Статистический.
5. Ретроспективный (анализ историй болезни).
Экспериментальные базы исследования: Психиатрическая больница № 14 Департамента Здравоохранения города Москвы (главный врач И.Г. Кожекин); лаборатория психофармакологии (зав. лабораторией - доктор медицинских наук М.А. Морозова) и лаборатория фармакокинетики (зав. лабораторией - доктор медицинских наук И.И. Мирошниченко) ФГБНУ "Научный центр психического здоровья" (директор – д.м.н., профессор, Т. П. Клюшник).
Характеристика выборки пациентов. В исследование были включены данные 197 пациентов, в том числе информация о 108 пациентах была получена из медицинской документации, 89 пациентов были обследованы клинически, из них у 41 пациента был проведён ТЛМ АП.
Диагноз: Для первого этапа исследования - шизофрения в стадии обострения (любая форма, кроме вялотекущей). Для второго и третьего этапов -обострение приступообразно-прогредиентной шизофрении. Код диагноза по МКБ-10: F20 [Тиганов А. С., 2003].
Критерии включения: В исследование были включены пациенты обоего пола в возрасте от 23 до 60 лет, госпитализированные в связи с обострением шизофрении. Для клинически обследованных пациентов дополнительными критериями были информированное согласие на участие в исследовании, приступообразно-прогредиентная форма шизофрении и прием монотерапии или комбинации максимум из 2-х антипсихотиков, при этом доза второго не должна была превышать 200 мг в хлорпромазиновом эквиваленте. В качестве основного антипсихотика пациенты должны были получать один из следующих препаратов: галоперидол, зуклопентиксол, клозапин, рисперидон, кветиапин, оланзапин, арипипразол, палиперидон.
Критерии исключения: сопутствующие психические заболевания, нестабильное соматическое состояние, требующее значительной коррекции терапии; сопутствующий диагноз наркомании или алкоголизма; ВИЧ, гепатиты В и С; отказ больного от выполнения требований протокола; заболевания ЖКТ, способные клинически значимо нарушать всасывание лекарств.
Основные положения, выносимые на защиту.
1. Паттерны назначения психофармакотерапии обострения шизофрении в рутинной практике свидетельствуют о потребности в дополнительных способах индивидуализации лечения на этапе раннего терапевтического ответа.
2. При обострении шизофрении качество раннего терапевтического ответа зависит не только от особенностей течения болезни и ведущего психопатологического синдрома, но и от концентрации антипсихотиков в плазме крови.
3. Эффективность терапии на раннем этапе лечения обострения шизофрении выше у больных с оптимальной концентрацией антипсихотиков и ниже у больных с отклонениями концентрации. При этом наибольшая разница отмечается в динамике негативных, а наименьшая - позитивных симптомов.
4. Повышенная концентрация антипсихотиков не только увеличивает риск развития побочных эффектов, но и негативно сказывается на результатах лечения.
5. Назначение антипсихотиков в рекомендованных по инструкции дозах не исключает возможности отклонения уровня препарата в плазме крови от оптимального диапазона, что связано с высокой индивидуальной вариабельностью концентрации.
6. Полученные данные позволяют рекомендовать применение терапевтического лекарственного мониторинга антипсихотиков для индивидуализации терапии обострения шизофрении на раннем этапе лечения в повседневной практике.
Достоверность научных положений и выводов обеспечивается проведённым автором лично тщательным изучением репрезентативной выборки пациентов (всего в исследование были включены данные 197 пациентов), комплексными мультимодальными методами исследования (клинико-психопатологический, психометрический, масс-спектрометрический для ТЛМ, статистический), позволившими решить поставленные задачи, получить валидные результаты и следующие из них выводы.
Апробация результатов исследования. Результаты исследования на разных этапах работы представлялись на конференциях: «Человек и Лекарство» (Москва, 2013); «Трансляционная медицина –инновационный путь развития современной психиатрии» (Самара, 2013); «Междисциплинарный подход в понимании и лечении психических расстройств: миф или реальность?» (Санкт Петербург, 2014); Euromedica (Ганновер, 2014), «Научная конференция молодых ученых, посвященная 110-летию со дня рождения А.В. Снежневского» (Москва, 2014), 16 Съезд психиатров России (Казань, 2015).
Апробация диссертации состоялась 26 мая 2015 г. на межотделеньческой конференции ФГБНУ НЦПЗ.
Внедрение результатов исследования. Результаты данного исследования нашли своё применение в повседневной практике в Государственном Бюджетном учреждении здравоохранения города Москвы «Психиатрическая больница № 14 Департамента Здравоохранения города Москвы» и в Государственном бюджетном учреждении здравоохранения Центральной московской областной клинической психиатрической больнице.
Публикация результатов исследования. Основное содержание и результаты исследования отражены в 7 публикациях, в том числе 3 из них в изданиях, рецензируемых ВАК Минобрнауки РФ.
Объем и структура диссертации. Диссертация изложена на 209 страницах машинописного текста (основной текст 156 страниц, приложение 53 страницы) и состоит из введения, семи глав, заключения, выводов, списка сокращений, списка литературы и приложения. Библиографический указатель содержит 264 наименования (из них отечественных - 60, иностранных - 204). В работе приведено 20 таблиц и 8 рисунков.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты работы продемонстрировали целесообразность применения ТЛМ АП для индивидуализации терапии обострения приступообразно-прогредиентной шизофрении в рутинной практике.
Изучение литературных источников показало, что часть неудач в лечении обострения шизофрении могут быть связаны с отклонениями концентрации АП от оптимального терапевтического диапазона [Hiemke C., 2011,2012; Mauri M. C. et al., 2007]. В то же время, в клинических исследованиях, посвященных связи концентрации АП и клинического ответа, были получены противоречивые результаты: часть из них обнаружила эту связь [Morselli P.L. et al., 1982; Balant-Gorgia A.E. et al., 1999; Gex-Fabry M. et al., 2003, Olesen O.V., Linnet K., 1999; Skogh E. et al., 2002; Dahl S.G., 1982; Simpson G.M., Yadalam K., 1985], а часть нет (DeVane C.L., Nemeroff C.B., 2001; Fellows L. et al., 2003; Lostia A.M. et al., 2009; Panagiotidis G. et al., 2007; Seto K. et al., 2011]. Сравнительный анализ этих исследований позволил предположить, что отрицательные результаты могут быть связаны с недостаточной гомогенностью исследуемых групп. Так как лекарственный ответ зависит от многих факторов, однородный состав пациентов в исследуемой группе позволяет в значительной степени нивелировать их воздействие, что необходимо для анализа влияния именно концентрации АП. Для решения этой задачи была создана модель исследования, позволяющая, насколько это возможно, свести до минимума влияние иных факторов.
Для формирования модели исследования и подтверждения её релевантности потребностям клинической практики, был проведён первый этап работы, предметом изучения которого стали паттерны назначения психофармакотерапии обострения шизофрении в рутинной клинической практике. Для решения этой задачи был проведён ретроспективный анализ 108 историй болезни пациентов, госпитализированных в связи с обострением шизофрении. В результате была получена информация о наиболее часто используемых для лечения вышеуказанного состояния АП, применении комбинированного лечения, сопутствующей терапии. Так, наиболее широко из круга типичных нейролептиков назначался галоперидол (30 % пациентов), а атипичных антипсихотиков - клозапин (8 %) и рисперидон (7 %). Эти данные были использованы при формировании списка антипсихотиков для исследования с помощью ТЛМ. Большинство пациентов (71 %) получали комбинацию АП с самого начала терапии, и в целом лекарственные схемы были достаточно массивны: холинолитические препараты получали 83 % пациентов, транквилизаторы - 53 %. В связи с этим было принято решение о включении в последующие этапы работы больных, получающих комбинацию антипсихотиков, так как исследование только монотерапии, предпочтительное с точки зрения фармакокинетического подхода, охватывало бы только незначительную часть рутинной практики. Помимо этого, назначение комбинированных схем терапии свидетельствует в пользу применения ТЛМ, так как в этой ситуации могут возникать малопредсказуемые фармакокинетические взаимодействия между препаратами.
Дальнейший анализ результатов первого этапа исследования показал, что большинству пациентов (57 %) потребовалась значительная коррекция первоначально назначенной схемы лечения (смена или добавление дополнительного АП), причем в среднем эта коррекция происходила на третьей неделе терапии. В целом полученные результаты подтвердили релевантность модели раннего терапевтического ответа потребностям рутинной практики и актуальность оценки целесообразности проведения ТЛМ АП именно в этот период лечения.
Так как у большинства пациентов (57 %) в обследуемой группе была отмечена приступообразно-прогредиентная форма шизофрении, было принято решение о включении на последующих этапах пациентов именно с этим типом основного заболевания как охватывающем значительную часть рутинной практики.
В целом результаты первого этапа соответствовали данным, полученным в других исследованиях рутинной практики, в том числе эпидемиологическим [Снедков Е.В. и Бадри К., 2007; Любов Е. Б. и соавт., 2012].
Таким образом, первый этап работы позволил окончательно определить модель исследования - ранний терапевтический ответ при обострении приступообразно-прогредиентной шизофрении, подтвердить актуальность изучаемой темы, а также уточнить психофармакологические критерии включения для группы клинически обследованных пациентов.
На втором этапе были клинически обследованы 89 пациентов с обострением приступообразно-прогредиентной шизофрении. Целью этого этапа было выявление наиболее значимых характеристик пациентов, оказывающих влияние на качество раннего терапевтического ответа. Решение данного вопроса было необходимо для корректной оценки влияния именно индивидуальных особенностей концентрации АП на эффективность лечения. Результаты нашего исследования показали, что на качество раннего терапевтического ответа клинически значимое влияние оказывают особенности течения основного заболевания и ведущий психопатологический синдром обострения. Критерий достаточной эффективности раннего терапевтического ответа был определен как 20 % или более редукция общего балла по шкале PANSS к третьей неделе терапии, что является общепринятым для оценки результатов этого этапа лечения [Kinon B.J., 2008; Correl et al., 2003; Obermeier M., 2012]. Результаты анализа данных показали, что среди пациентов с тенденцией к непрерывному течению приступообразно-прогредиентной шизофрении процент респондеров был в два раза меньше (14 %) в сравнении с группой, характеризовавшейся типичным течением данного заболевания (28 %). В отношении ведущего психопатологического синдрома наибольшая эффективность лечения была отмечена у пациентов с депрессивно-параноидным синдромом (50 % респондеров), наименьшая - у пациентов с галлюцинаторно-параноидным (14 % респондеров). Полученные результаты относительно особенностей реакции на лечения в зависимости от характеристик основного заболевания были в значительной степени ожидаемы и соотносились с литературными данными [Мосолов С. Н., 2004; Никифорова И. Ю., 1991; Циркин С. Ю. 1980]. При анализе роли отдельных симптомов выяснилось, что среди респондеров обнаруживается большая выраженность импульсивного поведения и меньшая выраженность моторной заторможенности. Кроме того, значимым позитивным прогностическим фактором стала критичность пациентов к своему состоянию, что также соотносится с результатами других исследований [Морозова М.А. 2003]. В то же время, такие факторы как пол, возраст, длительность заболевания, возраст манифестного приступа и тип АП не оказали значительного влияния на эффективность раннего этапа лечения, что, по-видимому, связано со значительным влиянием универсальных патофизиологических факторов в состояние пациентов в этот период. Отдельно стоит отметить, что в достаточной степени на первый курс терапии ответили только около 20 % пациентов, что дополнительно подтвердило актуальность поиска способов оптимизации антипсихотического лечения.
Таким образом, на качество раннего терапевтического ответа наиболее значимое влияние оказали особенности основного заболевания, что было учтено при формировании подгруппы для следующего этапа исследования и оценке его результатов.
Третий (заключительный) этап исследования был посвящён оценке влияния индивидуальных особенностей концентрации АП на качество раннего терапевтического ответа у больных с обострением приступообразно-прогредиентной шизофрении. Критерии включения и исключения пациентов, а также дизайн исследования базировался на результатах предыдущих этапов работы. Так, значительное влияние характеристик заболевания на эффективность терапии потребовало отбора в изучаемую группу пациентов с различными ведущими психопатологическими синдромами и особенностями течения. Помимо этого, анализ историй болезни выявил наиболее часто использующиеся в рутинной практике схемы лечения обострения шизофрении, что позволило сделать обоснованный выбор АП для фармакокинетического анализа и сформулировать терапевтические критерии включения. В итоге для 41 из клинически обследованных пациентов был проведён ТЛМ АП (на 7-10 и 21-28 дни от начала лечения), более подробное психометрическое обследование (PANSS, NSA и CGI), а также оценка выраженности ПЭ (клинически- по шкале UKU, лабораторно- по показателям уровня глюкозы, пролактина и ДГЭА в плазме крови). Результаты анализа полученных данных показали, что у пациентов с оптимальной (в обеих исследованных точках) концентрацией АП эффективность раннего терапевтического ответа была выше, чем у пациентов с отклонениями концентрации. Подтверждением этому служат статистически достоверные различия в пользу пациентов с оптимальной концентрацией в динамике общего балла по шкале PANSS (р<0,05) (см. Рисунок 1) и показателю шкалы общеклинического впечатления CGI-I (р<0,05). Анализ динамики подшкал и ФМ шкалы PANSS показал, что все группы психопатологических симптомов (позитивные, негативные, депрессивные и др.) лучше отвечают на лечение в группе оптимальной концентрации АП.
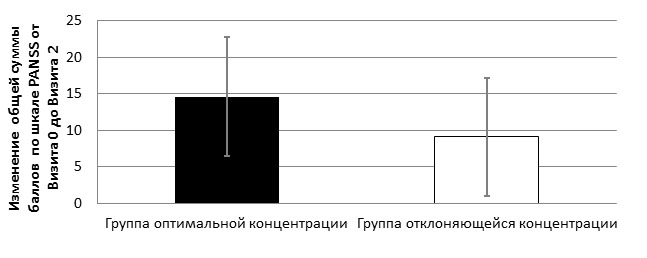
Рисунок 1 - Динамика изменения общего балла по шкале PANSS в зависимости от концентрации АП
При этом статистической достоверности достигали различия в отношении тревоги, депрессии и негативной симптоматики, что отразилось в следующих показателях: ФМ тревоги-депрессии, подшкала общей патологии, ФМ негативный (см. Рисунок 2), общий балл по шкале NSA (во всех случаях p<0,05).
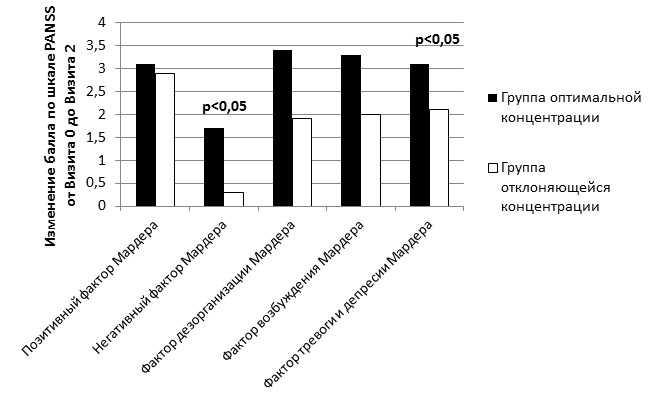
Рисунок 2 - Динамика изменения показателей ФМ шкалы PANSS в зависимости от концентрации АП
Анализ корреляций между динамикой различных групп психопатологических симптомов выявил большее число связей в группе оптимальной концентрации антипсихотиков (10 статистически достоверных корреляций) в сравнении с группой отклоняющейся концентрации (4 статистически достоверных корреляции). Этот факт свидетельствует о содружественной реакции на терапию различных групп симптомов как отражение более широкого терапевтического спектра оптимальной концентрации АП.
С учетом результатов второго этапа работы для исключения искажения полученных данных из-за случайного накопления пациентов с определёнными психопатологическими синдромами и особенностями течения заболевания, был проведён анализ состава группы нормальной концентрации АП по этом факторам. Результаты показали, что распределение пациентов соответствовало таковому в общей группе: галлюцинаторно-параноидный – 9 пациентов из 26 в общей группе (29 % от общего числа больных с данным синдромом), депрессивно-параноидный – 2 из 7 (34 %), паранойяльный – 3 из 8 (37 %). Таким образом было показано, что концентрация АП оказывает самостоятельное влияние на ранний терапевтический ответ при обострении приступообразно-прогредиентной шизофрении.
Результат исследования, касающийся большей эффективности терапии АП в группе с оптимальной концентрацией, согласуется с данными многих исследований [Giegling I. et al., 2010; Hasegawa M. et al., 1993; Kronig M.H. et al., 1995; Perry P.J. et al., 1991; Potkin S.G. et al., 1994; Vanderzwaag C. et al., 1996; Morselli P.L. et al., 1982; Balant-Gorgia A.E. et al., 1999; Olesen O.V. et al., 1998; Rummel-Kluge C. et al., 2012; Müller M.J. et al., 2007; Gex-Fabry M. et al., 2003; Olesen O.V., Linnet K., 1999; Perry P.J. et al., 2001; Rao M.L. et al., 2001; Skogh E. et al., 2002; Dahl S.G., 1982; Simpson G.M., Yadalam K., 1985; Midha K.K. et al., 1993]. То, что в части исследований связи между концентрацией АП и эффективностью терапии обнаружено не было [DeVane C.L., Nemeroff C.B., 2001; Fellows L. et al., 2003; Lostia A.M. et al., 2009; Panagiotidis G. et al., 2007; Seto K. et al., 2011], может объясняться недостаточным учётом как индивидуальных особенностей пациентов при составлении исследуемых групп, так и прочих факторов, способных повлиять на эффективность лечения. Известно, что АП имеют доказанную эффективность именно в отношении позитивных симптомов в период обострения шизофрении, что объясняется механизмом их действия и особенностями патогенеза шизофрении [Buchanan R.W., 2010]. Так, в период обострения у подавляющего большинства пациентов обнаруживается чрезмерная активизация допаминовой системы [Lodge D.J.,A. A. Grace 2011; Yilmaz Z., 2012]. Соответственно, АП, являясь блокаторами допаминовых рецепторов 2-го типа в этот период демонстрируют наиболее отчётливую зависимость эффективности лечения от степени заблокированности этих рецепторов [Kapur S. et al.,2000]. Таким образом, факторы, относящиеся непосредственно к психофармакотерапии, в ранний период лечения обострения шизофрении выступают на первый план. Именно поэтому выбор модели раннего терапевтического ответа для изучения связи между эффективностью терапии и концентрацией АП позволил создать условия для изучения влияния именно концентрации АП на эффективность лечения.
Помимо недостаточной эффективности, существенной проблемой психофармакотерапии обострения шизофрении является частое возникновение ПЭ [Blair D.T.,Dauner A. , 1992; Boyda H.N. et al., 2013; Rummel-Kluge C. et al., 2012; Alvir J.M. et al., 1993; Boyda H.N. et al., 2013]. В связи с этим оценка клинической значимости влияния концентрации АП на выраженность ПЭ является важным в практическом отношении вопросом, так как открывает перспективы для индивидуализации терапии обострения шизофрении в контексте улучшения безопасности и переносимости. В рамках нашей работы анализ влияния концентрации АП на выраженность ПЭ проводился как по клиническим признакам (шкала UKU), так и по некоторым лабораторным показателям (уровням глюкозы, пролактина и ДГЭА в крови). Для проведения этого анализа была выделена подгруппа пациентов, у которых хотя бы в одной из проб была обнаружена повышенная относительно оптимального терапевтического диапазона концентрация АП в плазме крови. В эту группу вошло 14 пациентов (34 %). Статистическая обработка результатов по шкале UKU показала, что при повышенной концентрации АП у пациентов достоверно чаще возникали только гиперкинезия и акатизия (p<0,05), что соотносится с данными литературы [Shen W.W., 1981;Van Putten T. et al., 1991]. Отсутствие связи повышенной концентрации АП с такими дозозависимыми ПЭ как ригидность, тремор и другие ЭПС, мы рассматриваем как результат профилактического назначения большинству пациентов (83 %) холинолитических препаратов (в первую очередь тригексифенидила). Кроме того, часть ПЭ могла быть связана с сопутствующей терапией, которую получали пациенты, что в некоторой степени способно было повлиять на полученные результаты.
Далее была проведена оценка лабораторных показателей. В общей группе пациентов было отмечено повышение уровня глюкозы в крови в 17 % случаев, при этом связи с повышенной концентрацией АП обнаружено не было. Это результат соответствует литературным данным [Czerwensky F. et al., 2013] и описанным ПЭ тех препаратов, которые получали данные пациенты. Следующим изученным лабораторным показателем был уровень ДГЭА. Данный показатель был повышен у 9 пациентов (22 %), пониженного уровня отмечено не было. Влияния особенностей концентрации АП на уровень ДГЭА обнаружено не было. При этом повышенный уровень ДГЭА оказал некоторое влияние на терапевтический ответ, отразившись в худшей реакции симптомов возбуждения на проводимое лечение. Данный результат в некоторой степени согласуется с теоретическими предпосылками, так как на животных было показано, что повышенный уровень ДГЭА может приводить к усилению агрессивности [Watson R., 2011]. Клиническая значимость влияния уровня ДГЭА на терапевтическую динамику при обострении шизофрении требует дальнейшего исследования вне рамок нашей работы.
Стоит отдельно остановиться на подробном обсуждении проблемы гиперпролактинемии, так как данное отклонение было выявлено у большинства обследованных пациентов (66%). Важно отметить, что зачастую повышение уровня пролактина остаётся незамеченным врачами [Sernyak M.J. et al., 2005], так как во многих случаях не сопровождается очевидными для этого состояния симптомами. Например, в нашем исследовании галактореи и гинекомастии не было обнаружено ни у одного из пациентов с повышенным уровнем пролактина. В то же время, гиперпролактинемия может вызвать сексуальные расстройства (как у мужчин, так и у женщин), аменорею и гипоменорею, остеопороз, онкологические заболевания молочных желёз [Мельниченко Г.А. и соавт., 2007]. Касательно области психического здоровья, имеются сведения о связи гиперпролактинемии с депрессивным синдромом, тревогой, а также, что существенно для обследованной в нашем исследовании группе, с психотическими состояниями [Мельниченко Г.А. и соавт. , 2007; Kinon B.J.et al., 2003]. В отношении текущего обострения шизофрении, теоретически это может приводить к персистированию имеющегося психоза и возникновению постпсихотической депрессии [Шумская К.Н., 1999]. В нашем исследовании было обнаружено более частое возникновение выраженных депрессивных симптомов (оценка 4 и выше по пункту G6 «Депрессия» по шкале PANSS) в группе со значительным (в 3 раза и более) повышением уровня пролактина- 28 % против 14 % в группе с меньшим уровнем этого гормона. Кроме того, уровень пролактина был статистически достоверно выше (p<0,05) в группе повышенной концентрации АП, что соответствует литературным данным. Этот результат свидетельствует в пользу того, что оптимизация схемы терапии с использованием данных ТЛМ может привести к меньшей частоте возникновения клинически значимой гиперпролактинемии.
Таким образом, в нашем исследовании было обнаружено, что при повышенной концентрации АП чаще возникают такие ПЭ антипсихотической терапии, как акатизия, гиперкинезии и гиперпролактинемия.
Вышеизложенные результаты исследования, демонстрирующие существенное влияние уровня АП в плазме крови на качество раннего терапевтического ответа, приобретают большую значимость при принятии во внимание широкой индивидуальной вариабельности концентрации АП. Так, в обследованной нами группе уровень АП в плазме крови в 66 % случаев отклонялся от оптимального, несмотря на назначение рекомендованных по инструкции дозировок препаратов. Полученные результаты соответствуют литературным данным [ Preskorn S.H. et al., 1993; Preskorn S. H., 2008; Bachmann C.J. et al., 2008; Molden E. et al., 2006]. Эта ситуация связана с индивидуальными особенностями пациентов, которые могут оказать своё влияние на различных этапах фармакокинетического взаимодействия организма и лекарственного препарата. Во-первых, это этап всасывания, в котором важную роль могут сыграть отклонения в функционировании ферментных систем, характер питания, заболевания ЖКТ, сопутствующая терапия и др. [Ших Е. В., 2007; Brune K., 1985; Bailey D.G. et al., 2013; Остроумова О. Д. и соавт., 2003]. Во-вторых, важным аспектом является распределение препарата. Здесь так же возможна значительная индивидуальная вариабельность, например, за счёт различий в активности Р-гликопротеина, осуществляющего транспорт различных молекул, в том числе некоторых лекарственных препаратов, через гематоэнцефалический барьер [Schinkel A.H.,1999]. Третьим этапом является метаболизм препарата различными ферментными системами, в основном находящимися в печени [Cavallari L.H.et al., 2011; Streetman D.S. et al., 2000]. В отношении многих АП важными ферментами метаболизма являются цитохромы системы Р450 [Brøsen K., 1996; Dahl M.L., Sjöqvist F., 2000; Linnet K., Wiborg O., 1996], активность которых, в свою очередь зависит от многих факторов, индивидуальных для каждого фермента [Agundez J.A., 1995,2004; Arranz M.J., Kapur S., 2008; Bondolfi G., 2005; Chainuvati S., 2003; Derenne J.L., Baldessarini R.J., 2005; Gurley B.J. et al., 2005; Hiemke C., Pfuhlmann B., 2012; Jaquenoud S. E. et al., 2006; Zullino D.F. et al., 2002; Jaquenoud S. E. et al., 2006; Zhou S.F. et al., 2010]. На последнем фармакокинетическом этапе - экскреции препарата - такие состояния как печеночная или почечная недостаточность могут оказать существенное влияния на конечную концентрацию препарата в плазме крови [Белоусов Ю. Б., Леонова М. В., 2002]. Суммируя вышеизложенную информацию можно констатировать тот факт, что на каждом из описанных этапов могут произойти значительные отклонения от некого среднего, «нормального» процесса взаимодействия организма и препарата, с учётом которого рассчитываются рекомендуемые в инструкции дозы. Решением данной проблемы может стать индивидуализация подбора дозы АП с использованием результатов ТЛМ.
Таким образом, поэтапная структура работы позволила создать релевантную как поставленным целям, так и потребностям рутинной практики модель исследования, на которой было продемонстрировано существенное влияние особенностей концентрации АП в плазме крови на ранний терапевтический ответ у больных с обострением приступообразно-прогредиентной шизофрении, что свидетельствует в пользу применения ТЛМ для индивидуализации психофармакотерапии данного состояния.
ЗАКЛЮЧЕНИЕ
Результаты диссертационного исследования по теме «Роль терапевтического лекарственного мониторинга антипсихотиков в индивидуализации терапии обострения приступообразно-прогредиентной шизофрении» позволили сформулировать следующие выводы:
1. Результаты первого этапа исследования продемонстрировали, что существует потребность в дополнительных способах индивидуализации лечения в период раннего терапевтического ответа при обострении приступообразно-прогредиентной шизофрении. В пользу этого свидетельствуют массивные лекарственные схемы, где увеличивается опасность неконтролируемых фармакокинетических взаимодействий между препаратами, и частая смена терапии в начале лечения.
2. Результаты второго этапа показали, что у подавляющего большинства пациентов эффективность раннего терапевтического ответа при обострении приступообразно-прогредиентной шизофрении недостаточна. При этом наиболее значимыми в отношении прогноза оказались характеристики основного заболевания: особенности течения и психопатологическая картина обострения, тогда как другие факторы (возраст, пол, длительность заболевания, возраст манифестации, особенности психофармакотерапии) не оказали значительного влияния.
3. Результаты третьего этапа исследования позволяют сделать вывод о том, что качество раннего терапевтического ответа при обострении приступообразно-прогредиентной шизофрении зависит от концентрации антипсихотиков:
3.1 Эффективность терапии выше у пациентов с оптимальной (в рамках терапевтического диапазона) концентрацией антипсихотиков, чем у пациентов с отклонениями концентрации.
3.2 Наибольшие отличия в динамике состояния в пользу пациентов с оптимальной концентрацией отмечаются в отношении негативных симптомов, наименьшие - в отношении позитивных.
3.3 Оптимальная концентрация антипсихотиков в плазме крови обеспечивает более широкий терапевтический спектр эффективности, проводя к содружественной динамике всех групп психопатологических симптомов, тогда как при отклонениях концентрации этого не отмечается.
3.4 Концентрация антипсихотиков оказывает самостоятельное влияние на качество раннего терапевтического ответа, не перекрывающееся влиянием особенностей психопатологической картины заболевания.
4. Повышенная концентрация антипсихотиков не только сопровождается большей выраженностью побочных эффектов, но и негативно сказывается на результатах лечения. Во всяком случае отчасти эти два факта взаимосвязаны, так как побочные эффекты, чаще наблюдаемые при превышении оптимального уровня концентрации антипсихотиков, непосредственно способствуют персистированию некоторых психопатологических симптомов.
5. Применение антипсихотиков в рекомендованных по инструкции дозах не предотвращает отклонения концентрации препарата в плазме крови от оптимального терапевтического диапазона. Высокая индивидуальная вариабельность фармакокинетики приводит к тому, что у большинства пациентов отмечаются отклонения концентрации. При этом опора только на клиническую картину состояния не позволяет предотвратить возникновения этой ситуации.
6. Применение терапевтического лекарственного мониторинга антипсихотиков с целью индивидуального подбора дозировок на раннем этапе терапии обострения шизофрении может способствовать повышению эффективности и безопасности проводимого лечения. В первую очередь этот метод может быть полезен для пациентов, не отвечающих в достаточной мере на проводимое лечение и испытывающих выраженных дозозависимые побочные эффекты. Терапевтический лекарственный мониторинг может быть рекомендован как один из наиболее приемлемых способов индивидуализации антипсихотической фармакотерапии в повседневной клинической практике.
Практические рекомендации и перспективы дальнейшей разработки темы
Рекомендации по практическому применению ТЛМ АП для индивидуализации лечения обострения приступообразно-прогредиентной шизофрении подробно изложены в тексте диссертации. Основными показаниями для данной методики являются недостаточная эффективность терапии, выраженные дозозависимые ПЭ, проверка комплаентности и добавление сопутствующей терапии, способной значимо повлиять на концентрацию АП в плазме крови. В случае, если результат исследования показал отклонение концентрации, рекомендуется произвести соответствующую корректировку дозы АП и через 7-10 дней контрольный ТЛМ. Перспективным для дальнейшего исследования представляется изучение вопроса влияния концентрации АП на последующие этапы терапевтического ответа (становление ремиссии, ремиссия), в том числе при различных формах шизофрении (непрерывной, детской и др.), а также при других состояниях, требующих антипсихотической терапии (биполярное расстройство с психотической симптоматикой, шизоаффективный психоз и др.).
Список работ, опубликованных по теме диссертации
1. Потанин, С.С. Возможные подходы к индивидуализации антипсихотической терапии при шизофрении / С.С. Потанин, Д.С. Бурминский, М.А. Морозова // Журнал неврологии и психиатрии им. С.С. Корсакова. –2013. – № 10. – С. 80–87.
2. Потанин, С.С. Теория и практика терапии обострения шизофрении (ретроспективное исследование) / С.С. Потанин, Д.С. Бурминский, М.А. Морозова // Журнал неврологии и психиатрии им. С.С. Корсакова.- 2014. – № 5. – С. 17–21.
3. Потанин, С.С. Перспективы применения терапевтического лекарственного мониторинга для оптимизации антипсихотической терапии / С.С. Потанин, М.А. Морозова // Психиатрия. – 2014. –№3. – С. 55.
4. Потанин, С.С. Использование терапевтического лекарственного мониторинга и анализа активности цитохромов P450 в качестве объективных критериев персонализации антипсихотической терапии / С.С. Потанин, Д.С. Бурминский, Е. В. Бондаренко, М.А. Морозова // В сб. Междисциплинарный подход в понимании и лечении психических расстройств: миф или реальность? – Санкт-Петербург, 2014. – С. 51–52.
5. Потанин, С.С. Использование терапевтического лекарственного мониторинга (ТЛМ) при лечении обострений шизофрении в рутинной клинической практике / С.С. Потанин, И.И. Мирошниченко, Д.С. Бурминский, Е. В. Бондаренко, А.И. Платова, М.А. Морозова // В сб. Трансляционная медицина – инновационный путь развития современной психиатрии.- Самара, 2014. – С. 164 – 165.
6. Потанин, С.С. Взаимосвязь концентрации антипсихотиков в плазме крови и эффективности терапии обострения шизофрении на раннем этапе лечения / С.С. Потанин, Д.С. Бурминский, М.А. Морозова, А.И. Платова, Н.В. Баймеева, И.И. Мирошниченко // В сб. XII Всероссийская школа молодых психиатров.- Суздаль, 2015. – С. 272–275.
7. Potanin, S.S. TDM in routine psychiatric practice / S.S. Potanin, I.I. Miroshnichenko, D.S. Burminsky, E.V. Bondarenko, A.I. Platova, M.A. Morozova // В сб. EuroMedica, Hannover, 2014. – С. 128–129.
